Page 192 - 《水产学报》2025年第8期
P. 192
曹磊,等 水产学报, 2025, 49(8): 089416
表 3 唯一肽段数>2 的 8 个候选互作蛋白
Tab. 3 8 candidate interacting proteins with >2 unique peptide counts
蛋白质 唯一肽段数 序列覆盖度/% 描述
protein unique peptide sequence coverage description
Hspa1 3 22.8 热休克蛋白1 heat shock protein 1
Sfswap 3 3.3 剪接因子SWAP splicing factor SWAP
Ndufa7 2 20.4 泛醌氧化还原酶亚基A7 NADH:ubiquinone oxidoreductase subunit A7
Fhl3 2 10 包含四个半LIM结构域的蛋白3 four and a half LIM domains 3
Hnrnpr 2 8.9 异质性核糖核蛋白 R heterogeneous nuclear ribonucleoprotein R
Clk1;Clk4 2 8.1 Cdc样激酶1/4 CDC like kinase 1/4
Fbxw11 2 4.5 含F-box和WD重复结构域11 F-box and WD-40 domain protein 11
Acaca 2 0.9 乙酰辅酶 A 羧化酶 α acetyl-Coenzyme A carboxylase alpha
定殖。效应蛋白 EseJ 的缺失可能导致不同与
杀鱼爱德华氏菌 ΔT3SS 菌株的毒力效应蛋白网络破坏,进而影
E. piscicida
响杀鱼爱德华氏菌杀鱼爱德华氏菌的感染定殖
水平。
巨噬细胞 另一方面,本研究发现 EseJ 是调控 PPARγ
macrophage
含量的关键效应蛋白。EseJ 是最早就被鉴定出
来的杀鱼爱德华氏菌 T3SS 效应蛋白之一,由
1 358 个氨基酸组成,分子量高达 146 ku,并且
线粒体失稳 EseJ 在其他物种中没有鉴定到同源蛋白。在早期的
mitochondrial 炎症
homeostasis inflammation 研究中,Xie 等 [11] 曾发现,EseJ 通过下调 I 型
disruption ROS
纤毛表达,降低杀鱼爱德华氏菌对宿主细胞的
PPARγ
黏附并抑制其凋亡。Zhang 等 [16] 也指出,EseJ
阻止宿主免疫细胞溶酶体的成熟从而逃脱免疫
ROS
清除。考虑到 EseJ 并不包含结合 DNA 的功能
域,因此,实验推测 EseJ 通过翻译后蛋白水平
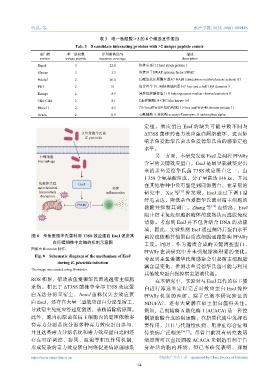
图 8 杀鱼爱德华氏菌利用 T3SS 效应蛋白 EseJ 促进其 调控或依赖其他蛋白质或细胞通路影响 PPARγ
在巨噬细胞中定殖的机制示意图
丰度。同时,作为脂质合成的关键调控蛋白,
图像由 Biorender 制作。
PPARγ 在该研究中并未引起脂滴积累的变化。
Fig. 8 Schematic diagram of the mechanism of EseJ
考虑到杀鱼爱德华氏菌感染会引起宿主细胞脂
during E. piscicida infection
滴含量变化,推测杀鱼爱德华氏菌可能与利用
The image was created using Biorender.
其他效应蛋白操控宿主脂滴代谢。
ROS 积累,帮助杀鱼爱德华氏菌逃逸宿主细胞 在本研究中,实验对与 EseJ 互作的宿主蛋
杀伤。相比于 ΔT3SS 菌株中全部 T3SS 效应蛋 白进行筛选鉴定以完善对效应蛋白 EseJ 操控
白无法分泌至宿主,ΔeseJ 菌株仅失去效应蛋 PPARγ 机制的理解。除了已被本研究验证的
白 EseJ,还存在大量三型效应蛋白分泌至宿主, NDUFA7,还有大量潜在宿主蛋白值得关注。
导致宿主免疫应答过度激活,杀伤清除病原菌。 例如,乙酰辅酶 A 羧化酶 1 (ACACA) 是一种控
此外,胞内病原菌在宿主细胞内的定殖依赖多 制脂肪酸合成的限速酶,在脂质代谢中发挥重
套毒力分泌系统分泌多种毒力效应蛋白参与, 要作用,并且与代谢性疾病、肥胖症综合症和
并且这些毒力分泌系统和毒力效应蛋白之间还 传染病广泛相关 [36-37] 。尽管目前没有研究表明
存在时序调控、协同、阻遏等相互作用机制, 病原菌可以直接调控 ACACA 来创造有利于自
形成复杂的毒力效应蛋白网络促进病原菌感染 身存活的胞内环境,但已有研究表明,抑制
https://www.china-fishery.cn 中国水产学会主办 sponsored by China Society of Fisheries
14