Page 147 - 《水产学报》2023年第1期
P. 147
李晓晖,等 1.5 1.5 水产学报, 2023, 47(1): 019610
miR-17a-5p 相对表达量 relative expression of miR17a-5p 1.0 a a c miR-17a-5p 相对表达量 relative expression of miR17a-5p 1.0 a a b a
0.5
0.5
0
1 b 2 3 4 0 1 2 3 4
不同低氧胁迫组 不同低氧胁迫组
different hypoxic stresses groups different hypoxic stresses groups
(a) 1.5 (b)
1.5
miR-17a-5p 相对表达量 relative expression of miR17a-5p 1.0 a b b miR-17a-5p 相对表达量 relative expression of miR17a-5p 1.0 a c c
0.5
0.5
0
1 2 3 c 4 0 1 b 2 3 4
不同低氧胁迫组 不同低氧胁迫组
different hypoxic stresses groups different hypoxic stresses groups
(c) (d)
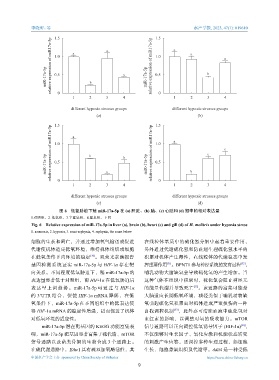
图 6 低氧胁迫下鲢 miR-17a-5p 在 (a) 肝脏、(b) 脑、(c) 心脏和 (d) 鳃中的相对表达量
1.对照组,2. 低氧组,3.半窒息组,4.窒息组,下同
Fig. 6 Relative expression of miR-17a-5p in liver (a), brain (b), heart (c) and gill (d) of H. molitrix under hypoxia stress
1. normoxia, 2. hypoxia, 3. semi-asphyxia, 4. asphyxia, the same below
细胞的生长和凋亡,并通过增加氧气输送或促进 在线粒体基质中的硫化氢分解中起着重要作用,
代谢使机体适应低氧环境,维持机体组织或细胞 另外通过代谢硫化氢和防止超生理硫化氢水平的
[30]
在低氧条件下内环境的稳定 。双荧光素酶报告 积累对机体产生毒性,在线粒体的代谢稳态中发
[32]
[31]
基因检测系统证实 miR-17a-5p 与 HIF-1α 存在靶 挥重要作用 。BPNT1 参与神经系统的发育过程 ,
向关系。不同程度低氧胁迫下,鲢 miR-17a-5p 的 哺乳动物大脑缺氧会导致硫化氢的产生增加。当
表达量显著低于对照组,而 HIF-1α 在低氧胁迫后 这种气体在组织中积聚时,硫化氢会阻止神经元
[33]
表达呈上调趋势。miR-17a-5p 可通过与 HIF-1α 的能量代谢并导致死亡 。该通路的富集可能是
的 3′UTR 结合,促使 HIF-1α mRNA 降解,在低 大脑适应长期低氧环境,减轻类似于哺乳动物缺
氧条件下,miR-17a-5p 在不同组织中的低表达使 氧引起硫化氢积累而对机体造成严重损伤的一种
[33]
得 HIF-1α mRNA 的稳定性增强,进而促进了机体 自我调控机制 ,此外亦可清除血液中硫化氢对
对低氧环境的适应性。 血红素的影响,以调整对氧的吸收能力。mTOR
[34]
miR-17a-5p 潜在靶基因的 KEGG 功能富集表 信号通路可以正向调控低氧诱导因子 (HIF-1α) ,
明,miR-17a-5p 靶基因显著富集于硫代谢、mTOR 不仅能够对生长因子、氧化应激和机能状态转变
信号通路以及萜类骨架的生物合成 3 个通路上。 的刺激产生应答,还调控多种生理过程,如细胞
在硫代谢通路中,Ethe1 具有硫双加氧酶活性,其 生长、细胞骨架组织及代谢等。ddit4 是一种受低
中国水产学会主办 sponsored by China Society of Fisheries https://www.china-fishery.cn
9